دکتر پیمان عشقی، فوق تخصص خون و سرطان کودکان
استاد دانشگاه علوم پزشکی شهید بهشتی و رئیس انجمن علمی ترومبوز هموستاز ایران
امروزه با پیشرفتهای علمی روزافزون در علوم پایه و فناوریهای پزشکی و داروسازی درمان بیماریهای خاص و صعبالعلاج به لطف داروهای مبتکرانه و شیوههای درمانی نوین، بهکلی متحول شده است. در این میان به نظر میرسد درمان هموفیلی و بیماریهای خونریزیدهنده ارثی نسبت به سایر بیماریهای خاص -ازجمله تالاسمی یا بیماران دیالیزی و مزمن کلیوی- از سرعت و تنوع بیشتری برخوردار است. در میان این پیشرفتها برخی از آنها را میتوان به لحاظ اثربخشی در کیفیت زندگی بیماران یک نقطه عطف تاریخی نامید. درمان هموفیلی که در دهه پنجاه میلادی با کشف رسوب کرایو از فرآوردههای خونی دچار انقلابی شده بود بهسرعت با دستیابی به فاکتورهای کنسانتره پلاسمایی، روشهای جدید و متنوع ویروسزدایی و کمخطر کردن و ایمنسازی این فرآوردهها و متعاقباً کشف روشهای مهندسی ژنتیک و تولید داروهای نوترکیب غیر پلاسمایی نسل اول و دوم و سوم، داروهای میانبر انعقادی و نهایتاً فاکتورهای انعقادی طویلالاثر بهسرعت اوج گرفت بهطوریکه تعقیب سیر این پیشرفتها و آشنایی با جزئیات و ویژگیهای همه این داروها و فرآوردهها نهتنها برای بیماران و خانوادههای آنها بلکه حتی برای متخصصین امر نیز که بهصورت حرفهای این روند را دنبال میکنند بسیار سخت شده است. در میان این پیشرفتها برخی از آنها را میتوان به لحاظ اثربخشی در کیفیت زندگی بیماران یک نقطه عطف تاریخی نامید. از دید نگارنده کشف رسوب کرایو، داروهای میانبر انعقادی (اعم از فیبا و هفت نوترکیب فعال) و داروهای نوترکیب را تا دهه اخیر میتوان در این زمره قرار داد.
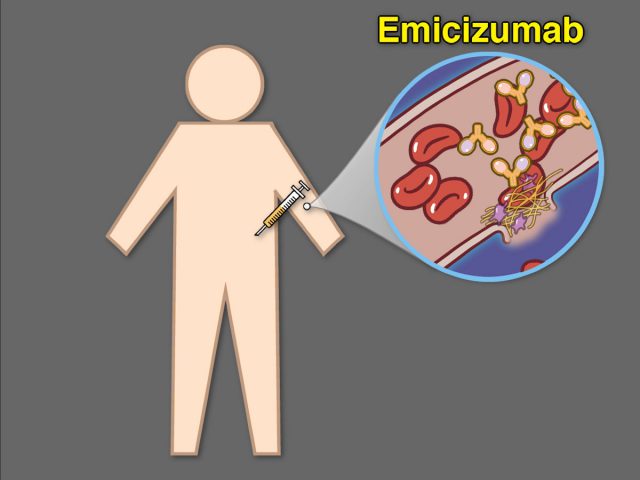
در چند سال اخیر انقلاب درمانی دیگری چه در حوزه «ژندرمانی» و چه تولید «داروهای جدید هموفیلی» در شرف وقوع و در حال مطالعه و ورود به بازار است. مهمترین و پرسروصداترین آنها در ۲ سال گذشته دارویی با نام علمی «امیسیزوماب» است که از جدیدترین سری داروهای پروفیلاکسی هموفیلی نوع A است و در سال ۲۰۱۷ وارد بازار جهانی شد. این دارو که یک آنتیبادی مخصوص است و عملکرد فاکتور ۸ انعقادی را در بدن بدون نیاز به فعال شدن سایر فاکتورهای انعقادی پیشنیاز شبیهسازی کرده و سبب فعالیت ادامه مسیر آبشار انعقاد میگردد، پس از ۳ مطالعه بینالمللی که در مجلات معتبر علمی منتشر شد به ترتیب در سالهای ۲۰۱۷ و ۲۰۱۸ به تائید سازمان غذا و دارو ایالاتمتحده (FDA) و آژانس دارویی اروپا (EMA) رسید و با تائید اثربخشی و ایمنی دارویی، هماکنون در بیش از ۸۷ کشور در سراسر دنیا اعم از توسعهیافته یا درحال توسعه برای درمان پیشگیرانه از خونریزیهای بیماران هموفیلی نوع A مورد استفاده قرار میگیرد. سه ویژگی اصلی این دارو آنرا سزاوار انتخاب عنوان نقطه عطف یا گام بلند تاریخی درمان میکند:
۱٫ این دارو اولین و اثربخشترین داروی انعقادی بیماران هموفیلی A (فاقد و دارای مهارکنندههای فاکتور انعقادی ۸) در ۲۰ سال اخیر است که بهصورت زیرجلدی تزریق میشود و نیاز به دسترسی وریدی را -که بهخصوص در کودکان عذابی مضاعف بر بیماری تلقی میشود- منتفی میکند.
۲٫ طول عمر بالای دارو در بدن به بیماران این انتخاب را خواهد داد تا بهجای تزریق مکرر و متعدد هفتگی در پیشگیری از خونریزی، طبق نظر پزشک معالج بازههای زمانی تزریق خود را از هفتهای یکبار تا حتی هر ۴ هفته یکبار-آنهم بهصورت زیرجلدی و در منزل- تنظیم کنند.
۳٫ هرچند این دارو فعلاً برای درمان خونریزیهای موردی به کار نمیرود، ولی با کاربرد پیشگیرانه آن بهویژه در بیماران واجد مهارکننده ضدفاکتور خونریزیهای خودبهخودی سالیانه بیماران بهطور چشمگیری کاهش یافته و اصولاً نیازی به درمان خونریزیهای موردی باقی نمیماند. در مطالعه بالینی صورت گرفته در مقیاس جهانی در بالغین دارای آنتیبادیهای ضد فاکتور مهارکننده، داروی امیسیزوماب سبب شد که دفعات خونریزی سالیانه در مقایسه با کسانی که از سایر داروهای میانبر موجود پیشگیریکننده استفاده میکردند ۷۹ درصد و در مقایسه با کسانی که هیچ پیشگیری انجام نمیدادند ۸۶ درصد کاهش یابد. همچنین در مطالعه مربوط به کودکان دارای مهارکننده نشان داده شد که متعاقب مصرف این دارو میزان خونریزی در مفاصل هدف این کودکان _که در طی سال خونریزیهای مکرر و آسیبرسان خودبهخودی و بدون تروما را از خود نشان داده بودند_ نزدیک به صفر بوده است.
موارد مصرف این دارو چیست؟
علیرغم موارد مصرف در حال گسترشی که برای این دارو تعریف شده است، مورد مصرف اصلی این دارو در حال حاضر در جهان «پیشگیری از بروز خونریزی در بیماران هموفیلی A شدید واجد مهارکننده ضد فاکتور انعقادی» است. به عبارتی این دارو مانع از بروز خونریزیهای مکرر و پرهزینه در این دسته از بیماران میشود. بدیهی است در صورت بروز خونریزی درمانهای میانبر موجود جایگاه خود را خواهند داشت. همچنین فعلاً علیرغم تائید مطالعات در خصوص پیشگیری در سایر بیماران بدون مهارکننده، هنوز این مورد مصرف عمدتاً به دلیل محدودیت منابع، گسترش جهانی زیادی نیافته است.
طبق آمار جهانی تا سال ۲۰۱۸،۳۷۱ هزار بیمار مبتلا به هموفیلی نوع A (0.005 درصد از جمعیت جهان) در سراسر جهان شناسایی شدهاند که ۲۵ تا ۴۰ درصد از این بیماران دارای مهارکنندههای فاکتور انعقادی ۸ هستند. در کشور ما نیز تعداد ۵۱۰۰ بیمار مبتلا به هموفیلی، یعنی ۰٫۰۰۶ درصد از جمعیت کشور از هموفیلی نوع A رنج میبرند که ۱۳ تا ۱۸ درصد از این تعداد دارای مهارکنندههای فاکتور انعقادی ۸ تشخیص داده شدهاند. در این بیماران به دلیل وجود آنتیبادیهای ضد فاکتور انعقادی در بدن، کنترل خونریزیها با فاکتور ۸ انعقادی مقدور نیست و باید از میانبرهای انعقادی بسیار گرانقیمت استفاده کرد. از اینرو در کشورهای بسیاری از جمله ایران اصلاً درمان پیشگیرانه و قبل از بروز خونریزی با داروهای میانبر در این بیماران مقدور و در دسترس نیست و تنها به درمان خونریزی پس از وقوع میپردازیم که این روش پر عارضه و پرهزینه است. دفعات خونریزی سالیانه -بهخصوص مفاصل- با توجه به عدم دسترسی به داروی مورد نیاز کافی حتی از هموفیلی شدید عادی بالاتر و تنها در خصوص خونریزیهای مفصلی بهطور میانگین کلی حدود ۲۵ بار در سال است. میانگین کلی سرانه هزینه درمان این خونریزیها در ایران با داروهای میانبر موجود اعم از تولید داخل یا خارجی بیش از دو میلیارد تومان در سال به ازای هر بیمار است. با این وجود به دلیل عوارض خونریزیهای مکرر سرنوشت مفاصل کودکان به تخریب و نهایتاً تعویض مفاصل کشیده میشود.
از طرف دیگر پروتکل درمانی این خونریزیها بهصورت تزریقهای متعدد و هر چند ساعت یکبار _بسته به نوع داروی میانبر مصرفی_ بهصورت داخل وریدی است. با تجویز پیشگیرانه امیسیزوماب بر اساس مطالعات بهعمل آمده، دفعات خونریزی کلی از ۲۸ بار در سال به کمتر از ۶ بار کاهش مییابد و در کودکان ۹۴ درصد موارد اصلاً خونریزی سالیانه نخواهند داشت و این با دریافت هفتهای یک دوز تا ماهی یک دوز دارو بهصورت زیر جلدی حاصل میشود. امری که بیماران را قادر خواهد ساخت فارغ از نگرانی درمان خونریزیهای مکرر و غیرقابل کنترل خود با آرامش و کیفیت بیشتری به زندگی خود ادامه دهند.
ایمنی دارو
از ابتدای مطالعات بالینی و پس از ورود دارو به بازار جهانی با تأییدیه فارماکوپههای معتبر، مهمترین عارضه دارویی گزارش شده نوعی ازترومبوز یا لخته شدن بیش از حد داخل عروق کوچک، در تداخل مصرف توأم با یکی دیگر از داروهای میانبر انعقادی در جریان خونریزیهای حین درمان است که سبب هشدار در استفاده توأم داروی میانبر مذکور در دوزهای بالا شده است. در سایر موارد عارضه جدی گزارش نشده است.
صرفه اقتصادی دارو
همانطور که در بالا آمد مصرف داروهای میانبر موجود در موارد مصرف آنها بسیار پرهزینه است؛ اما از سوی دیگر با توجه به هزینه بالای داروی جدید، نگرانی در جامعه علمی و مدیران اجرایی کشور در خصوص هزینه -اثربخشی این داروی جدید در مقایسه با درمانهای موجود و عدم کفاف منابع جهت تأمین این داروی جدید وجود داشت. هرچند در مطالعات اقتصاد داروی بهعمل آمده و منتشر شده در سطح جهان مصرف پیشگیرانه امیسیزوماب هزینه- اثربخشی و بهصرفه بودن خود را در شرایط خاصی نشان داده بود ولی مطالعات اقتصاد درمان بومی شده در این زمینه ضروری بود. لکن با توجه به اینکه این دارو فعلاً در ایران در دسترس نیست، امکان مطالعه میدانی اقتصاد درمان در مورد آن وجود نداشت. لذا حسب دستورالعمل الزامآور ضوابط ارزیابی اقتصادی داروهای جدید از سازمان غذا و دارو به شرکت دارویی مربوطه یک مطالعه براساس مدلسازی اقتصادی بهعمل آمده که با شاخصهای خونریزی بیماران ایرانی (سن بیماران، تعداد مفاصل هدف بیماران، خونریزی سالیانه کلی، خونریزیهای شدید و خفیف و مکرر مفصلی، اعمال جراحی، تعویض مفصل،پروتکلهای درمانی موجود و حتی پروتکلهای فرضی پیشگیرانه با داروهای موجود و…)، قیمت داروهای موجود در بازار ایران، قیمت پیشنهادی امیسیزوماب در ایران، و شاخصهای اثربخشی دارو در مطالعات معتبر منتشر شده جهانی، توسط جمعی از اساتید دانشگاهی بهعمل آمد و به تائید کارگروه ثبت داروها در سازمان غذا و دارو رسید.
نتیجه این مطالعه نشان میداد که مصرف پیشگیرانه این دارو در تمام سنین در بیمارانی که بیش از ۱۵ بار در سال خونریزی دارند صرفه اقتصادی داشته و سبب ۱۱ تا ۱۴ درصد کاهش هزینه به ازای هر بیمار -بسته به سن بیمار- میشود. از اینرو بسیاری از کشورهای پیشرفته و در حال توسعه در اقصی نقاط جهان در پی معرفی این شیوه درمانی در حوزه خدمات درمانی هموفیلی هستند. بهعنوان مثال، طبق اخبار منتشر شده توسط سازمان خدمات ملی سلامت کشور انگلستان، این کشور اخیراً در راستای متحول ساختن کیفیت زندگی بیماران هموفیلی نوع A، طی طرحی ملی (حدود ۲۰۰۰ بیمار)، بودجه مشخصی را به تأمین داروی امیسیزوماب در پیشگیری اختصاص داده است.
چنین اقدامی به کشورهای توسعهیافته محدود نشده است و تأثیرات شگرف این دارو، حتی بسیاری از کشورهای در حال توسعه مانند گواتمالا، زیمباوه، نامیبیا، کاستاریکا، اندونزی، لبنان، کویت، برزیل، عمان، اردن، ترکیه، مصر، امارات متحده عربی و ترکمنستان که برخی از آنها نسبت تولید ناخالص داخلی کمتری در مقایسه با ایران دارند را نیز بر آن داشته است تا این دارو را در خدمات درمانی حوزه هموفیلی خود قرار دهند.
آینده دارو در ایران
با توجه به موارد فوق و براساس مطالعات موجود و تجربه جهانی بیش از ۳ سال در بازار گسترده جهانی در خصوص تائید اثربخشی، ایمنی و صرفه این دارو، همچنین تائید رسمی انجمن علمی ترمبوز و هموستاز ایران (که مرتبطترین انجمن علمی مصوب وزارت بهداشت درمان و آموزش پزشکی در این حوزه است و طی چند جلسه کارشناسی با «اجماع» تمام اعضا حاصل شد) و نیز براساس نظر سایر متخصصین و انجمنهای علمی مرتبط، فرآیند اداری و رسمی ثبت دارو حدود دوسال است که در کشور آغاز شده است. انتظار میرود با توجه به موارد فوق و تائید مطالعات فناوری سلامت و مدلسازی اقتصادی از سوی سازمان غذا و دارو دال بر صرفه اقتصادی غالب در برخی از بیماران و نیز عدم موجود بودن داروی ژنریک تولید داخل مشابه، پروسه ثبت این دارو حداقل در مرحله اول برای تعداد محدودی از بیماران که «دفعات بالای خونریزی داشته و بهخصوص در کودکان که فاقد دسترسی به رگ محیطی مناسب هستند» سریعاً به اتمام برسد.
هرچند با ورود این دارو سایر داروهای انعقادی میانبر موجود در بازار ایران جایگاه مصرف علمی خود را از دست نخواهد داد، ولی بر اساس مدلسازی اقتصادی بهعمل آمده انتظار میرود در این بیماران «واجد شرایط» علاوه بر کاهش هزینه سلامت که حدود ۲۳۰ تا ۴۶۰ میلیون تومان به ازای هر بیمار در سال تخمین زده میشود، صرفهجویی ارزی -که در شرایط فعلی خود یکی از اهداف راهبردی نظام دارو و درمان کشور است- حاصل شده و علاوه بر آن سبب ارتقاء کیفیت زندگی بیماران و رضایتمندی آنها از نظام سلامت کشور شود.
بدیهی است در صورت برداشته شدن گام اول پایلوت، روند مصرف دارو به دقت زیر نظر ناظرین و کارشناسان وزارت بهداشت و انجمنهای علمی و مراکز دانشگاهی معتبر و معتمد رصد شده و پس از یکسال مطالعه اقتصاد دارویی میدانی و واقعی، نتیجه شاخصهای درمانی و هزینههای مستند و ثبت شده آن جهت تصمیمگیری برای گسترش یا محدودیت احتمالی ورود دارو در سالهای بعد در اختیار سیاستگذاران مربوطه قرار خواهد گرفت. در غیر این صورت هیچ پاسخی در برابر وجدان حرفهای خود، بیماران و خانوادههای ایشان، مجامع علمی داخلی و خارجی و حتی سیاستگذاران اقتصادی و کلان کشور در حال و آینده نخواهیم داشت.
منبع: شماره ۶۸ مجله خاص